-
-
-
Tổng tiền thanh toán:
-

Ứng dụng phân tích phổ hấp thụ nguyên tử trong hoạt động kiểm định vắc xin
Đăng bởi ThietbiQC vào lúc 14/01/2022
Phương pháp quang phổ hấp thụ nguyên tử (AAS:Atomic Absorption Spectrometry ) là một kỹ thuật phân tích rất mạnh trong định lượng hầu hết các Kim loại và một số Phi kim. Nó hoạt động dựa trên nguyên lý : khi nguyên tử ở trạng thái tự do nhận năng lượng chúng chuyển lên mức năng lượng cao hơn gọi là trạng thái kích thích. Quá trình đó gọi là quá trình hấp thụ năng lượng và tạo ra phổ hấp thụ nguyên tử đặc trưng. Dựa vào phổ hấp thụ nguyên tử này người ta có thể phát hiện và định lượng nguyên tố đó. Trong quá trình sản xuất vắc xin và các chế phẩm sinh học người ta cho vào một lượng nhất định Thiomersal làm chất diệt khuẩn. Bằng cách định lượng nguyên tố thủy ngân có mặt trong các mẫu ta có thể xác định được hàm lượng Thiomersal. Nhôm được cho vào vắc xin đóng vai trò làm chất hấp phụ. Cũng như Thiomersal, hàm lượng Nhôm có trong vắc xin cũng cần được kiểm soát. Từ khóa : Quang phổ hấp thụ nguyên tử
1.Giới thiệu
Quang phổ hấp thụ nguyên tử (AAS:Atomic Absorption Spectrometry ) là một kỹ thuật phân tích rất mạnh có độ nhạy và độ chính xác rất cao. Đối tượng chính của nó là phân tích lượng vết các kim loại trong các loại mẫu khác nhau của các chất vô cơ và hữu cơ. Với các trang thiết bị và kỹ thuật hiện nay, bằng phương pháp phân tích này người ta có thể định lượng được hầu hết các kim loại (khoảng 65 nguyên tố) và một số á kim đến giời hạn nồng độ cỡ ppm bằng kỹ thuật ngọn lửa và đến nồng độ ppb với kỹ thuật không ngọn lửa với sai số nhỏ không hơn 15%.
Ở nhiều nước trên thế giới, nhất là các nước phát triển, phương pháp phân tích phổ hấp thụ nguyên tử đã trở thành một phương pháp tiêu chuẩn để định lượng nhiều kim loại trong các mẫu quặng, đất, đá, nước khoáng, các mẫu y học, sinh học, các sản phẩm nông nghiệp, rau quả, thực phẩm, các nguyên tố vi lượng trong phân bón …
Bên cạnh kim loại một vài phi kim như Si, P, S. Se. Te cũng được xác định bằng phương pháp này. Các kim loại khác như C, Cl, C, O, N không xác định được trực tiếp, cần có bộ đơn sắc đặc biệt hoặc sử dụng các phương pháp gián tiếp.
2. Nguyên lý
Như chúng ta đã biết, vật chất được cấu tạo bởi các nguyên tử và nguyên tử là phần tử cơ bản nhỏ nhất còn giữ được tính chất của mỗi nguyên tố hóa học. Nguyên tử lại bao gồm hạt nhân nguyên tử nằm ở giữa và chiếm một thể tích rất nhỏ và các điện tử (electron) chuyển động xung quanh hạt nhân và trong phần không gian lớn của nguyên tử. Trong điều kiện bình thường nguyên tử không thu và cũng không phát ra năng lượng dưới dạng các bức xạ. Lúc này nguyên tử tồn tại ở trạng thái cơ bản. Đó là trạng thái bền vững và nghèo năng lượng nhất của nguyên tử.
Nhưng khi nguyên tử ở trạng thái tự do, nếu ta chiếu một chùm sáng đơn sắc có những bước sóng (tần số) xác định vào đám hơi nguyên tử đó, các nguyên tử tự do sẽ hấp thụ chọn lọc các bức xạ (tia sáng) có bước sóng nhất định ứng đúng với những tia bức xạ mà nó có thể phát ra được trong quá trình phát xạ của nó (phổ phát xạ). Lúc này nguyên tử đã nhận năng lượng của các tia bức xạ chiếu vào nó và nó chuyển sang trạng thái kích thích có năng lượng cao hơn trạng thái cơ bản. Đó là một tính chất của nguyên tử ở trạng thái hơi. Quá trình này được gọi là quá trình hấp thụ năng lượng của nguyên tử tự do ở trạng thái hơi cơ bản và tạo ra một phổ nguyên tử của các nguyên tố hóa học đó. Phổ sinh ra trong quá trình này được gọi là phổ hấp thụ nguyên tử (phổ AAS) và đây là một tính chất vật lý đặc trưng cơ bản của nguyên tử.
Để hiểu hơn về nguyên lý này chúng ta xét đến một mô hình cơ bản là nguyên tử Hydro với 1 nhân và 1 electron quay xung quanh như hình dưới. Các mũi tên cho thấy sự chuyển đổi điện tử từ mức năng lượng cao hơn sang mức năng lượng thấp hơn. Năng lượng của các photon phát ra giống như sự chênh lệch năng lượng giữa hai mức năng lượng. Chúng ta có thể nghĩ về sự hấp thụ là quá trình ngược lại. Các mũi tên sẽ hướng lên trên và các electron sẽ nhảy lên mức cao hơn khi chúng hấp thụ một photon có năng lượng phù hợp.
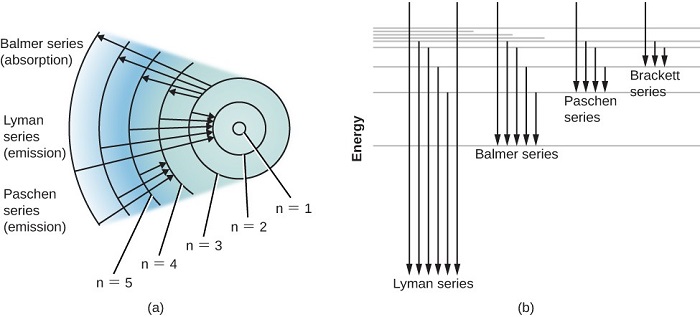
Hình 2: Các mức năng lượng của nguyên tử Hydro
3. Nguyên tắc
Muốn thực hiện được phép đo phổ hấp thụ nguyên tử của một nguyên tố cần phải thực hiện các quá trình sau:
·Chọn các điều kiện và trang bị phù hợp để chuyển mẫu phân tích từ trạng thái ban đầu (rắn, lỏng, huyền phù) sang trạng thái hơi của các nguyên tử tự do.
·Chiếu chùm tia bức xạ đặc trưng của nguyên tố cần phân tích qua đám hơi nguyên tử vừa tạo ra. Các nguyên tử của các nguyên tố cần xác định trong đám hơi đó sẽ hấp thụ những tia bức xạ nhất định và tạo ra phổ hấp thụ của nó. Phần cường độ của chùm tia đã bị nguyên tử hấp thụ là phụ thuộc vào nồng độ của nó trong môi trường hấp thụ.
·Tiếp đó nhờ một hệ thống máy quang phổ người ta thu được toàn bộ chùm sáng, phân ly và chọn vạch hấp thụ của nguyên tố cần nghiên cứu để đo cường độ của nó. Trong một giới hạn nhất định của nồng độ C, giá trị cường độ ánh sáng I phụ thuộc tuyến tính vào nồng độ C của nguyên tố có mặt trong mẫu phân tích.
4. Định lượng Nhôm trong vắc xin và các chế phẩm sinh học
Vắc xin và các chế phẩm sinh học thường ở thể lỏng hay hoàn nguyên về thể lỏng tương đối đồng nhất nên việc vô cơ hóa mẫu tương đối dễ dàng nhất là ngày nay với sự hỗ trợ mạnh mẽ từ các thế hệ lò vô cơ mẫu chuyên dụng hiện đại. Nguyên tố nhôm có thể được định lượng bằng hệ thống AAS với cả 2 kỹ thuật. Kỹ thuật ngọn lửa F-AAS với độ nhạy (LOD) 0,05 ppm và vùng tuyến tính 0,5-15ppm, vạch phổ đo 309,30 nm. Kỹ thuật không ngọn lửa GF-AAS với độ nhạy (LOD) 0,5 ppb và vùng tuyến tính 2-30 ppb, vạch phổ 309,30 nm.
5. Định lượng Thiomersal trong vắc xin và các chế phẩm sinh học
Thiomersal với công thức phân tử C9H9HgNaO2S có một nguyên tử Hg trong phân tử. Ta định lượng Thiomersal gián tiếp qua định lượng Hg có trong mẫu thử. Hg được định lượng bằng kỹ thuật hóa hơi lạnh hydrua hóa với độ nhạy phát hiện (LOD) 0,25 ppb, độ nhạy định lượng (LOQ) 1,0 ppb và vùng tuyến tính 1,0-10 ppb, vạch phổ 253,60 nm. Nguyên tắc có kỹ thuật này như sau:
Trong những điều kiện nhất định một số nguyên tố trong đó có Hg(II) có khản năng phản ứng với hdro mới sinh, hay chất khử mạnh trong môi trường axit sinh ra hợp chất hydrua ở trạng thái khí, hợp chất này dễ bị nguyên tử hóa phân lý thành các nguyên tử tự do có khả năng hấp thụ quang. Hợp chất HgH2 có nhiệt độ phân hủy thấp khoảng 20oC. Do vật ở kỹ thuật này ta không phải đun nóng cuvet thạch anh mà tiến hành ngay ở nhiệt 
 độ phòng. Phương trình phản ứng: Hg (II) + NaBH4 + H+
độ phòng. Phương trình phản ứng: Hg (II) + NaBH4 + H+  HgH2
HgH2  Hg(k)
Hg(k)

